qPCR
qPCR的原理:
实时荧光定量PCR技术(Real-timeQuantitativePCR,qPCR)是指在PCR反应体系中加入可与DNA产物特异性结合的荧光基团,利用荧光信号积累实时监测整个PCR进程,最终通过相对定量(与内参基因对比)或绝对定量(通过标准曲线对未知模板进行定量)的方法确定各个样本的本底表达量。SYBRGreenⅠ法和TaqMan探针法是常用的qPCR检测方法。
SYBRGreenⅠ法:
嵌入到双链DNA分子后在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后构象发生变化,能够吸收497nm的激发光并发出520nm的荧光;而不掺入DNA双链中的染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
TaqMan探针法:
扩增时加入一个特异性的寡核苷酸荧光探针,两端分别标记一个报告荧光基团和一个淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5′-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步
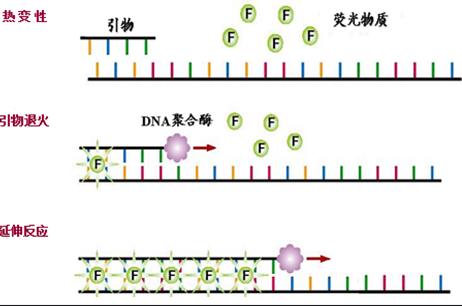
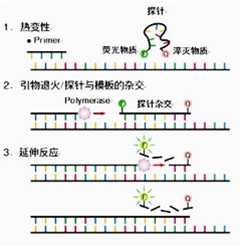
SYBRGREEN法和TaqMan探针法的区别:
| 方法 | 优点 | 缺点 |
|---|---|---|
| SYBRGREE | 高灵敏度,操作简单,不影响酶促反应,价格便宜 | 1 对引物特异性要求较高,需进行熔解曲线分析 2 灵敏度相对较低。 |
| TaqMan | 1 具有高度特异性 2 更高的灵敏度 3 可同时检测几种不同的荧光信号的产物 |
1 探针价格较高 2 需要不同引物的扩增效率一致,扩增条件要求比较高 |
qPCR的实验方法:
| 实验方法 | 原理 | 技术应用 |
|---|---|---|
| 绝对定量(AQ) | 基因在样本中的分子数,即通常所说的拷贝数。 | 特定微生物的拷贝数检测 特定功能基因的拷贝数检测 特定抗性基因的拷贝数检测 |
| 相对定量(RQ) | 基因在样本中的含量的相对比例,一般是通过CT值之差来计算。 | 特定微生物拷贝数占全部微生物拷贝数的比例 功能基因的微生物拷贝数占全部微生物拷贝数的比例 抗性基因拷贝数占全部微生物拷贝数的比例 |
相关应用:
1 临床疾病诊断
2 动物疾病检测
3 食品安全
4 科学研究
5 应用行业:各级各类医疗机构、大学及研究所、CDC、检验检疫局、兽医站、食品企业及乳品厂等。
相对定量和绝对定量的数据计算方法
标准质粒拷贝数计算:
每微升拷贝数(copies/μl)=[质粒浓度(ng/ul)×10-9×6.02×1023]/克隆产物相对分子质量
原始样本目标基因拷贝数copies/μLDNA=拷贝数*稀释倍数
原始样本目标基因拷贝数copies/g样本=(原始样本目标基因拷贝数copies/μLDNA*基因组DNA体积)/样本抽提重量,(如果客户样本为DNA样本,则不需要计算copies/g样本)
相对定量的计算:
步骤1:内参基因均一化样本差异:Ct目的基因–Ct内参基因=△Ct
步骤2:其他样本和对照样本比较:△Ct处理样本–△Ct对照样本=△△Ct
步骤3:使用公式计算:倍数变化=2–△△Ct
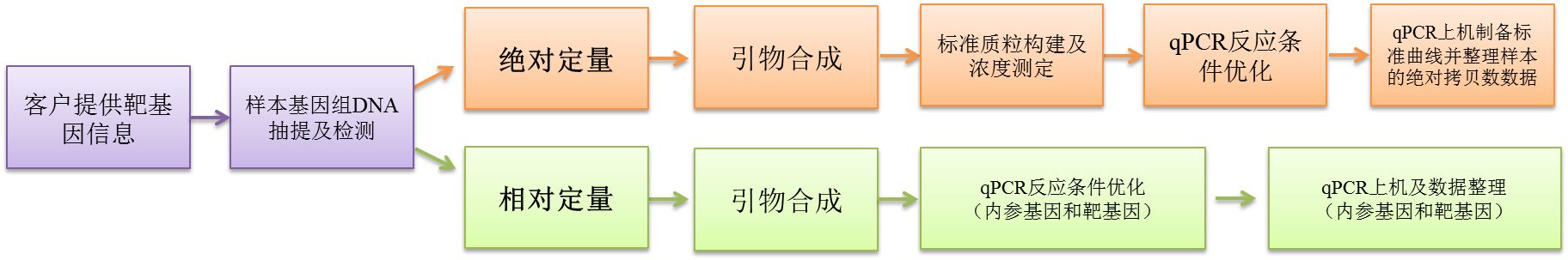
标准曲线
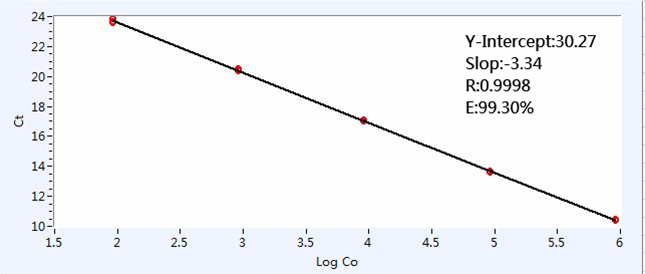
扩增曲线
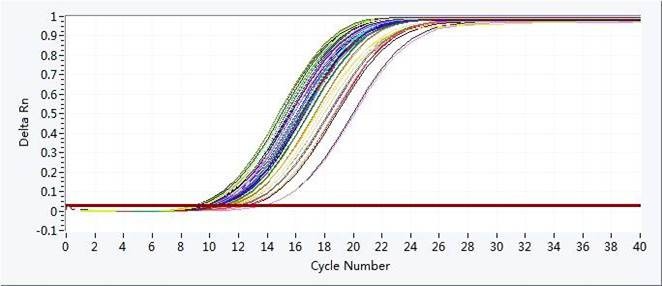
熔解曲线
定量结果
| 编号 | 拷贝数 | 样本稀释倍数 | 样本重量(g) | 基因组DNA体积(μL) | 基因拷贝数copies/μL DNA |
|---|---|---|---|---|---|
| 1 | 1.08E+06 | 200 | 0.237 | 50 | 2.17E+08 |
| 1 | 1.23E+06 | 200 | 0.237 | 50 | 2.47E+08 |
| 1 | 1.07E+06 | 200 | 0.237 | 50 | 2.14E+08 |
| 2 | 7.28E+05 | 200 | 0.24 | 50 | 1.46E+08 |
| 2 | 7.55E+05 | 200 | 0.24 | 50 | 1.51E+08 |
| 2 | 7.44E+05 | 200 | 0.24 | 50 | 1.49E+08 |
术语解释
Ct值(Cyclethreshold,循环阈值):每个反应管内的荧光信号到达设定阈值时所经历的循环数。
荧光阈值(threshold)的设定:PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光阈值的缺省(默认)设置是3-15个循环的荧光信号的标准偏差的10倍,即:threshold=10*SDcycle3-15
基线(baseline):在PCR扩增反应的最初数个循环里,荧光信号变化不大,接近一条直线,即称为基线。
熔解曲线Tm(TmOfMeltingCurve):SYBRGreen染料发实验结束后需对qPCR产物加热,随着温度的升高,双链接扩增产物逐渐解链,导致荧光强度下降,到达某一温度时,会导致大量的产物解链,荧光急剧下降,将此温度称为Tm值。不同PCR产物Tm值不同,从而可对PCR的特异性进行鉴定。
| 样本类型 | 样品量/例 | 备注 |
|---|---|---|
| 土壤/沉积物/淤泥 | 1g | |
| 湖水/海水/河水 | 1L,用滤膜或离心富集 | 过 0.22μm 的滤膜,或者 12000rpm 离心,进行富集。 |
| 污水 | 20ml | 若样本清亮则可适当地多取。 |
| 泥水混合样 | 2ml | |
| 空气 | 根据实验需要,用无菌滤膜过滤空气。 | |
| 发酵物 | 固体 2g,液体 20ml |
提醒:
1 因为qPCR绝对定量最终得到的是单位重量,或是单位体积目标基因的拷贝数,所以如果客户送DNA,建议客户记录抽提DNA时样本的使用重量或是体积,方便后继对数据进行转化。
2 送样时请尽量使用冰盒(泡沫盒+干冰),以保证运输过程中的低温条件(干冰的挥发消耗量约为 3-4 公斤/天)。在打包时放入足量的干冰, 将样本埋入干冰中, 为了保持冰盒中的低温环境,建议采用加厚的泡沫盒
参考文献:
1 Dan Chen et.al. Microbial community and metabolism activity in a bioelectrochemical denitrification system under long-term presence of p-nitrophenol.2018.Bioresource Technology.(narG nirK nirS napA)
2 Lei Wang et.al. Responses of bacterial and archaeal communities to nitrate stimulation after oil pollution in mangrove sediment revealed by Illumina sequencing.2016.Marine Pollution Bulletin.(nirK nirS)
3 Hailu Wu et.al . Effects of root exudates on denitrifier gene abundance, community structure and activity in a micro-polluted constructed wetland. 2017.ScienceoftheTotalEnvironment. (nirK nirS)
4 Suresh Kumar Dubeyet.al. Methane production potential and methanogenic archaeal community structure in tropical irrigated Indian paddy soils. 2014.Biol Fertil Soils.(mcrA)
5 Juanli Yun et.al. Diversity, abundance and vertical distribution of methane-oxidizing bacteria (methanotrophs) in the sediments of the Xianghai wetland, Songnen Plain, northeast China .2011.JSoilsSediments.(pmoA)
10Marc G.Dumontand J.Colin Murrell. Community‐Level Analysis: Key Genes of Aerobic Methane Oxidation.(pmoA)
6 Hongxia Du et.al.Mercury-methylatinggenes dsrB and hgcA insoils/sedim entsofthe Three Gorges Reservoir.2016.Environment Scientifi cPollution Research.(dsrB)
7 Si-Yu Zhang et.al. Si-Yu Zhang Diversity and Abundance of Arsenic Biotransformation Genes in Paddy Soils from Southern China.2015. Enveronmental Science Technology.(砷相关基因)